Daftar Isi
Apa itu usus bocor?
Nama medis untuk usus bocor adalah “permeabilitas usus” dan itu bukan penyakit atau gejala-permeabilitas usus adalah fungsi biologis alami. Melapisi usus Anda adalah penghalang sel; antara setiap sel adalah persimpangan ketat yang membuat hal-hal buruk (seperti racun dan bakteri jahat) keluar dari tubuh Anda dan memungkinkan hal-hal yang baik (nutrisi) masuk. Masalahnya adalah permeabilitas alami ini dapat menjadi kacau jika penghalang menjadi rusak. Pada orang yang rentan secara genetik, usus bocor dapat dipicu oleh gangguan bakteri usus dari pola makan yang buruk, beberapa obat atau gluten. Yang penting, para ahli tidak setuju tentang apa dan bukan pemicu. Tapi begitu permeabilitas terganggu, orang-orang jahat “bocor” ke dalam aliran darah Anda dan memicu peradangan, menyebabkan masalah kesehatan lainnya.
Untuk tujuan pencernaan dan penyerapan, manusia telah mengembangkan sistem gastrointestinal yang sangat rumit dan sangat khusus yang dipertahankan oleh penghalang mukosa 1). Epitel usus adalah permukaan mukosa terbesar yang menyediakan antarmuka antara lingkungan eksternal dan host mamalia. Mukosa usus menghadapi antigen luar yang luar biasa, termasuk antigen makanan, bakteri komensal, patogen, dan racun. Pengaturan anatomis dan fungsionalnya yang indah dan koordinasi fungsi pencernaan, penyerapan, motilitas, neuroendokrin, dan imunologi yang disetel dengan baik adalah kesaksian dari kompleksitas sistem gastrointestinal (GI). Juga penting adalah pengaturan perdagangan molekuler antara lumen usus dan submukosa melalui ruang paraseluler. Dengan demikian, fungsi penghalang khusus diperlukan untuk memblokir masuknya antigen eksterior yang berbeda sambil menyerap nutrisi.
Impressively, di usus, garis depan penghalang ini dikelola oleh hanya satu lapisan sel epitel khusus yang dihubungkan bersama oleh protein sambungan ketat (TJ). Banyak faktor lain yang membantu mendukung penghalang ini termasuk musin, molekul antimikroba, imunoglobulin, dan sitokin. Jika ada kelainan yang terjadi di antara faktor-faktor ini, permeabilitas usus dapat meningkat, yang disebut sebagai “usus bocor” 2). Sebuah usus bocor memungkinkan masuknya antigen eksterior dari lumen usus ke host, yang dapat mempromosikan respon imun lokal dan sistemik. Beberapa penyakit dapat timbul atau diperberat karena usus bocor, termasuk penyakit autoimun seperti penyakit radang usus, penyakit celiac, hepatitis autoimun, diabetes tipe 1, multiple sclerosis (MS) dan lupus eritematosus sistemik (SLE) 3), 4), 5), 6), 7). Banyak faktor dapat mempengaruhi permeabilitas usus, seperti berbagai senyawa yang diturunkan dari diet, konsumsi alkohol, dan dysbiosis mikrobiota usus.
Pelindung Usus
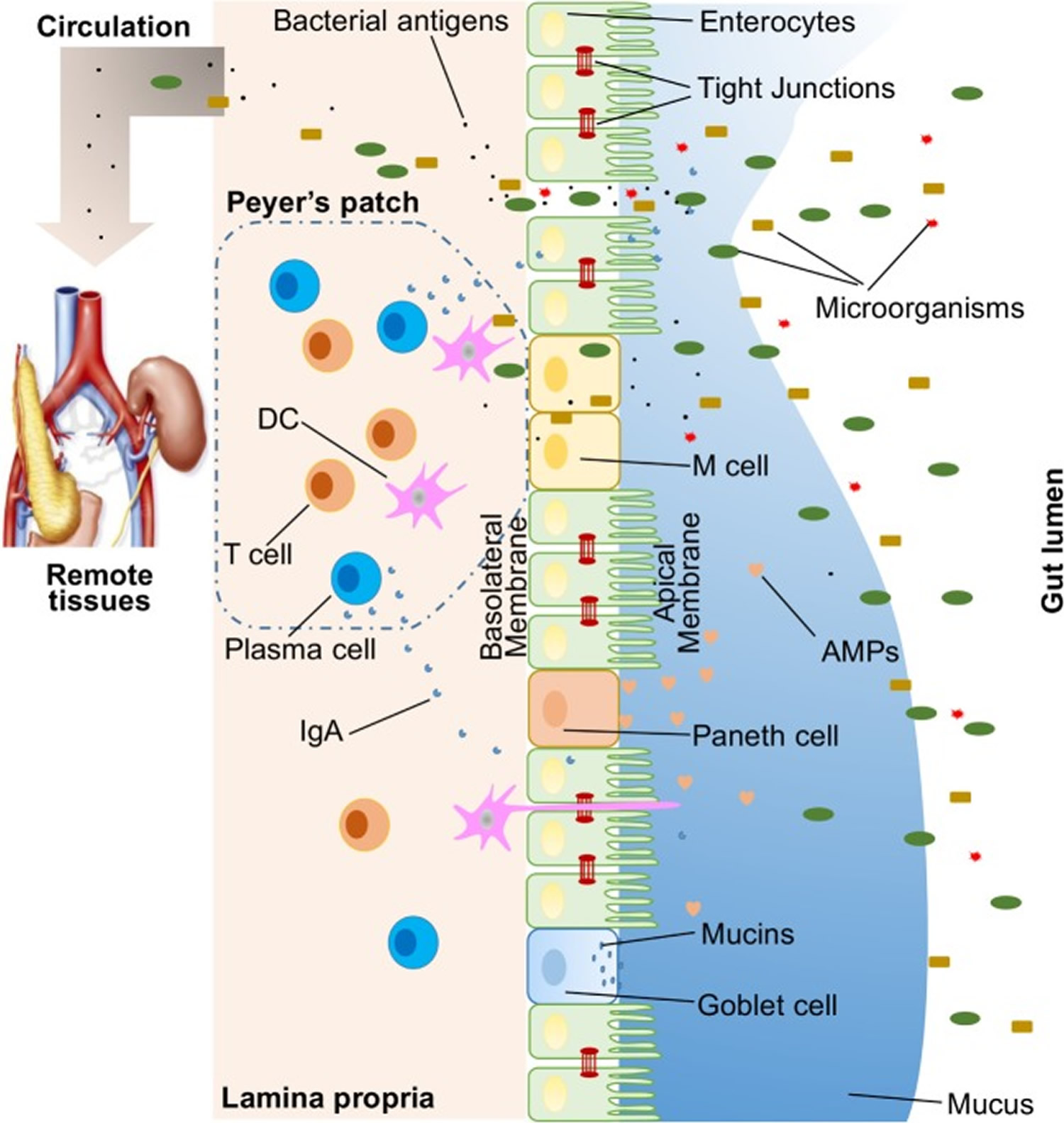
Berbagai macam zat eksogen menjajah lumen usus, seperti mikroorganisme, racun, dan antigen. Tanpa penghalang usus yang utuh dan berfungsi dengan baik, zat ini dapat menembus jaringan di bawah lapisan epitel usus, menyebar ke darah dan sirkulasi limfatik, dan mengganggu homeostasis jaringan. Namun, ada sistem barrier usus multifaset yang efisien dengan komponen fisik, biokimia, dan imunologi yang mencegah masuknya sebagian besar patogen (Gambar 1). Komponen-komponen ini saling berkoordinasi untuk mencegah translokasi isi luminal yang tidak terkontrol ke dalam tubuh. Di bawah ini adalah sinopsis singkat dari komponen utama yang terdiri dari penghalang usus.
Gambar 1. Ilustrasi hambatan usus host
Catatan: Ilustrasi hambatan usus host, termasuk penghalang fisik (epitelium, persimpangan ketat, lendir, bakteri komensal), penghalang biomedis [antimikroba protein (AMPs)], dan penghalang imunologi (limfosit dan IgA). Juga ditunjukkan adalah translokasi mikroba ke jaringan remote (misalnya, ginjal dan pankreas) di hadapan usus yang bocor.
[Sumber 8)]Penghalang Fisik
Pada manusia, epitelium usus mencakup seluas 400 m2 luas permukaan 9). Meskipun hanya satu lapisan sel, sel epitel usus (IECs) adalah andalan penghalang usus dan berfungsi sebagai penghalang fisik (Gambar 1). Setidaknya ada tujuh tipe sel epitel usus fungsional (IECs) -enterocytes, sel goblet, sel Paneth, sel-sel mikrofold (sel M), sel enteroendokrin, sel cup, dan sel-sel tuft, meskipun fungsi dari dua populasi sel terakhir adalah tidak dipahami dengan baik 10). Di antara semua jenis sel ini, enterosit mewakili mayoritas absolut, terhitung setidaknya 90% sel crypt atau sel villus. Enterosit adalah sel-sel penyerap dan penting untuk penyerapan nutrisi. Namun, semakin banyak bukti menunjukkan bahwa fungsi enterosit tidak terbatas pada penyerapan nutrisi. Sebagai contoh, enterocytes dapat mengontrol kelimpahan bakteri Gram-positif dengan mengekspresikan RegIIIγ, satu jenis protein antimikroba (AMPs) 11). Semua tipe sel epitel berasal dari Lgr5 + sel induk epitel usus, yang berada di dalam ruang bawah tanah 12). Tingkat turnover IECs tinggi dan sel-sel diperbarui setiap 3-5 hari di usus mamalia 13), dengan pengecualian adalah sel Paneth, yang memiliki rentang hidup sekitar 2 bulan.
Sel-sel epitel usus (IECs) terus menerus, dan kontak antara IECs disegel oleh persimpangan ketat (TJs) 14). Jalur paraseluler, berbeda dengan jalur transeluler, memungkinkan pengangkutan zat melintasi epitelium usus melalui ruang antara sel epitel usus (IECs). Berbagai macam molekul, terutama protein, mengontrol plastisitas sambungan ketat (TJs). Lebih dari 40 protein sambungan ketat (TJ) telah dikenal, termasuk occludin, claudins, junctional adhesion molecule A, dan tricellulin (17). Dalam berbagai kondisi patologis, permeabilitas paraseluler dapat ditingkatkan, sehingga masuknya molekul yang tidak diinginkan, berpotensi berbahaya.
Di atas epitelium usus, ada dua lapis lendir, lapisan dalam dan luar, yang menutupi seluruh lapisan epitel usus dan memberikan perlindungan fisik untuk memisahkan mikroorganisme luminal dari epitelium. Disusun oleh komponen utamanya, monomer pembentuk gel yang sangat glikosilasi MUC2, lendir mengandung beragam molekul termasuk IgA serta enzim dan protein, seperti laktoferin 15). Sel goblet adalah tipe sel sentral untuk pembentukan lendir. Mereka tidak hanya menghasilkan MUC2 musin tetapi juga rahasia komponen lendir lainnya seperti ZG16, AGR2, FCGBP, CLCA1, dan TFF3 16). Kolitis akan berkembang secara spontan pada tikus yang kekurangan Muc2, menunjukkan peran penting untuk MUC2 dalam perlindungan mukosa 17). Selain mukosa pembentuk gel, ada jenis lain musin yang dekat dengan sel epitel, yang disebut transmembran mucins. Enterocytes adalah produsen utama transmembran mucins 18).
Bakteri usus komensal telah digambarkan sebagai salah satu komponen dari penghalang fisik usus terutama karena dua fungsi utamanya 19). Yang pertama adalah untuk mempromosikan resistensi terhadap kolonisasi spesies bakteri berbahaya atau patogen dengan bersaing untuk nutrisi, menempati situs lampiran, dan melepaskan zat antimikroba 20). Selain itu, mikrobiota usus mengatur pencernaan dan penyerapan nutrisi untuk memasok energi ke sel epitel, yang merupakan komponen utama dari penghalang fisik 21). Contoh yang baik dari pasokan energi langsung adalah produksi asam lemak rantai pendek oleh mikrobiota usus, yang digunakan oleh kolonit untuk perkembangan dan metabolisme mereka 22). Secara bersama-sama, IECs, lapisan lendir, dan penduduk mikroba usus berfungsi sebagai penghalang fisik untuk membatasi masuknya isi luminal yang tidak bersahabat ke dalam jaringan inang.
Penghalang Biokimia
Molekul biokimia dengan sifat antimikroba ada di lendir serta jauh ke lumen dan termasuk asam empedu dan AMP 23) (Gambar 1). Molekul-molekul beragam membentuk jaringan yang rumit untuk mengurangi beban bakteri terjajah dan mengurangi kemungkinan kontak antara antigen luminal dan sel inang. Mereka adalah suplemen yang baik untuk penghalang fisik dan komponen penting dari fungsi penghalang usus.
Usus kecil proksimal mengandung sangat sedikit mikroorganisme 24). Tetapi karena jarak dari lambung meningkat, pH meningkat dan jumlah bakteri yang terjajah mengalami peningkatan 25). Menghadapi sejumlah besar mikroorganisme, yang kemungkinan melebihi jumlah sel tuan rumah, beberapa AMP dihasilkan untuk melawan penjajah. AMP ini dibagi menjadi beberapa tipe, termasuk α- dan β-defensin, lectin tipe-C, cathelicidin, lisosim, dan fosfatase alkalin intestinal (IAP) 26). Mekanisme antimikroba rinci mereka dibahas di tempat lain 27). Sebagai produsen AMP yang besar, tetapi tidak eksklusif, sel Paneth mendukung dan memediasi fungsi penghalang biokimia.
Penghalang Imunologis
Di bawah epitel usus, ada folikel limfoid yang terorganisir, termasuk bercak Peyer dan folikel limfoid yang terisolasi. Di dalam folikel, berbagai sel imun, termasuk sel B, sel T, sel dendritik (DC), dan neutrofil, mengatur respon imun dengan menghadirkan antigen, mensekresi sitokin, dan memproduksi antibodi pengikat antigen (Gambar 1). Dalam epitel usus di mana folikel limfoid ditemukan, sel M hadir bahwa antigen transcytose melintasi epitel usus ke patch Peyer di bawahnya 28). Menariknya, presentasi antigen spontan juga diamati di usus besar, tetapi hanya ketika tikus dibesarkan bebas kuman (GF), atau ditempatkan secara konvensional tetapi dengan pengobatan antibiotik oral 29). Hal ini menunjukkan bahwa proses penyerapan antigen dan pembentukan GAP diatur oleh mikrobiota kolon 30). Selain itu, sel goblet dan GAP mampu mendeteksi patogen invasif dan menghambat translokasi bakteri patogen ke dalam sistem kekebalan inang 31). Selanjutnya, fagosit mononuklear usus dapat merasakan dan sampel isi luminal 32). Sel mengekspresikan CX3CR1 bertanggung jawab untuk proses ini, dan sampling antigen tergantung pada struktur yang disebut dendrit transepitel (TED) 33). Pembentukan TED diatur oleh makrofag CX3CR1 + dan ekspresi CX3CL1 oleh IEC tertentu 34) .
Komponen lain dari penghalang imunologi adalah sekresi IgA (SIgA). Sebagai imunoglobulin yang paling melimpah dalam tubuh, IgA terutama berada di permukaan mukosa usus. Sementara beberapa orang dengan defisiensi IgA selektif tampaknya sehat, SIgA penting karena mungkin berinteraksi dengan bakteri komensal untuk memberikan perlindungan terhadap patogen. Sebuah fitur unik tentang SIgA adalah yang secara struktural ulet dalam lingkungan kaya-protease yang memungkinkannya untuk tetap aktif secara fungsional dibandingkan dengan isotipe antibodi lain pada permukaan mukosa 35). Pada manusia dewasa, sekitar 50 mg / kg SIgA diproduksi setiap hari oleh sel plasma yang berada di lamina propria usus. Akhirnya, SIgA dapat di transcytosed melalui epitel dan disekresikan ke dalam lumen usus.
Meskipun tidak disebutkan di sini, faktor self-modulasi, seperti saraf dan beragam sitokin, juga penting untuk mempertahankan fungsi normal dari penghalang usus.
Mekanisme Usus Bocor
Berbagai macam gangguan usus penghalang dan / atau gangguan mikrobiota usus dapat berpotensi mengakibatkan translokasi mikroba dan peradangan berikutnya secara lokal dan sistemik. Ini termasuk diet, infeksi, konsumsi alkohol, dan luka bakar.
Kebocoran Gangguan Diet
Nutrisi dan bahan makanan telah dilaporkan berkontribusi pada pemeliharaan atau perubahan mikrobiota usus dan fungsi penghalang usus 36). Ulasan terbaru oleh De Santis et al. rinci banyak faktor makanan yang dapat memodulasi penghalang usus 37). Beberapa publikasi baru-baru ini menekankan efek perubahan mikrobiota usus yang diinduksi oleh diet terhadap kompromi fungsi penghalang usus. Vitamin D telah diakui sebagai pelindung permeabilitas usus dengan menginduksi ekspresi protein TJ ZO-1 dan claudin-1. Pada tikus reseptor vitamin D (VDR), tikus percobaan yang lebih parah telah diamati, menunjukkan efek perlindungan vitamin D pada penghalang mukosa (Kong J, Zhang Z, Musch MW, Ning G, Sun J, Hart J, et al. Peran baru dari reseptor vitamin D dalam mempertahankan integritas penghalang mukosa usus. Am J Physiol Gastrointest Liver Physiol (2008) 294 (1): G208–16.10.1152 / ajpgi.00398.2007 http: //ajpgi.physiology .org / content / 294/1 / G208.long)). Namun, kelompok lain baru-baru ini menemukan bahwa kekurangan reseptor vitamin D menurun, sedangkan perawatan vitamin D meningkat, ekspresi klaudin-2, protein TJ membentuk pori, yang membuat epitel usus bocor 38). Analisis lebih lanjut menegaskan bahwa reseptor vitamin D meningkatkan aktivitas promotor claudin-2. Peran yang tepat dari vitamin D dan reseptor vitamin D pada modulasi permeabilitas usus karena itu tidak jelas dan harus diselidiki secara hati-hati dalam hubungan dengan mikrobiota usus. Dalam penelitian terbaru oleh Desai et al., Konsumsi diet rendah serat ditemukan untuk memicu perluasan bakteri pengurai lendir, termasuk Akkermansia muciniphila dan Bacteroides caccae 39). Akibatnya, ketebalan lendir secara signifikan menurun pada tikus yang diberi diet kekurangan serat, meskipun transkripsi gen Muc2 secara mengejutkan meningkat, mungkin sebagai respon kompensasi. Lendir yang lebih tipis dan fungsi penghalang usus yang terganggu menyebabkan kerentanan yang lebih tinggi terhadap patogen penyebab kolitis tertentu 40). Selain itu, diet tinggi lemak jenuh telah terbukti sangat mengurangi Lactobacillus dan meningkatkan Oscillibacter, dan perubahan ini berkorelasi dengan permeabilitas yang meningkat secara signifikan di kolon proksimal 41). Selanjutnya, penelitian menunjukkan bahwa kelimpahan genus Oscillospira berkorelasi negatif dengan ekspresi mRNA dari protein TJ pembentuk pembentuk ZO-1.
Induksi Stres Kebocoran Usus
Dalam keadaan tertentu, perubahan yang disebabkan oleh stres mikrobiota usus dan gangguan penghalang usus akan memungkinkan terjadinya translokasi mikroba. Luka bakar dan konsumsi alkohol adalah contoh dari stres semacam itu. Luka bakar mengakibatkan peningkatan permeabilitas usus, yang dimediasi oleh peningkatan aktivitas myosin rantai ringan (MLC) kinase 42) . Diketahui bahwa MLC fosforilasi atau aktivasi kinase dapat memicu pembukaan TJ epitel 43). Pada luka bakar, protein TJ, termasuk ZO-1, oklusi, dan claudin-1, didistribusikan kembali, yang dapat dibalik dengan menambahkan inhibitor fosforilasi MLC. Selain itu, baik manusia dan tikus yang mengalami luka bakar mengalami perubahan serupa mikrobiota usus, khususnya, dengan peningkatan kelimpahan bakteri dari keluarga Enterobacteriaceae 44). Yang penting, translokasi mikroba dari bakteri aerobik Gram-negatif ini telah diamati. Kelompok penelitian lain, menggunakan model tikus luka bakar yang berbeda melaporkan peningkatan permeabilitas kolon bersama dengan berkurangnya populasi bakteri aerob dan anaerob di mikrobiota usus, terutama yang memproduksi butirat 45). Sebagai akibatnya, tingkat butirat dalam tinja secara signifikan menurun pada tikus dengan luka bakar. Menariknya, ketika tikus percobaan menerima transplantasi mikrobiota fekal, jumlah bakteri yang diubah dan gangguan fungsi penghalang mukosa terbalik, menunjukkan keterlibatan langsung mikrobiota dalam menyebabkan kebocoran usus setelah luka bakar.
Konsumsi alkohol kronis bertanggung jawab untuk disfungsi penghalang usus, perubahan pada kualitas dan kuantitas mikrobiota usus, translokasi LPS, dan penyakit hati alkoholik (ALD). Baik manusia maupun tikus, telah terbukti bahwa alkohol dapat mengganggu fungsi penghalang usus, yang terkait erat dengan peningkatan produksi tumor necrosis factor (TNF) dari monosit intestinal / makrofag dan enterosit yang mengandung TNF-receptor 1, diikuti oleh aktivasi hilir dari MLC kinase 46). Khususnya, ketika tikus yang diberi alkohol kronis juga menerima pengobatan antibiotik oral, untuk menghilangkan mikrobiota, tingkat produksi TNF dan permeabilitas usus menurun ke tingkat yang sebanding dengan tikus kontrol 47). Hal ini menunjukkan bahwa kebocoran usus yang dimediasi oleh TNF yang diinduksi oleh alkohol sangat tergantung pada mikrobiota usus. Memang, meskipun mekanisme ini tidak diketahui, administrasi alkohol mengubah mikrobiota secara kualitatif dan kuantitatif baik pada manusia maupun tikus 48). Pertumbuhan bakteri berlebihan telah diamati dengan konsumsi alkohol, sedangkan antibiotik dapat menurunkan beban bakteri dan mengurangi ALD 49). Menariknya, probiotik Lactobacillus secara signifikan ditekan selama konsumsi alkohol 50). Langsung memasok strain Lactobacillus atau stimulasi tidak langsung dari Lactobacilli dengan prebiotik atau diet dapat menurunkan pertumbuhan bakteri yang berlebihan, mengembalikan integritas mukosa usus, dan menekan translokasi mikroba 51). Translokasi mikroba, terutama translokasi LPS, terlibat dalam pengembangan ALD dan perkembangan yang dibuktikan dengan kurangnya ALD pada tikus yang kekurangan TLR4 52). Perlu dicatat bahwa beberapa spesies bakteri dapat menghasilkan alkohol, termasuk E. coli dan Weissella confusa, dan ini mungkin mekanisme yang mereka kompromi fungsi penghalang usus 53).
Infeksi dapat memainkan peran dalam mengatur penghalang mukosa. Contoh yang baik adalah Helicobacter pylori, bakteri Gram-negatif yang menginfeksi perut manusia 54). H. pylori diketahui secara langsung meningkatkan permeabilitas epitel dengan mendistribusikan kembali protein TJ ZO-1 55). Selain itu, bakteriofag, yang biasanya tidak dianggap patogen terhadap mamalia, dapat berdampak pada usus bocor. Ketika tikus diberi koktail bakteriofag yang mengandung fag terhadap Salmonella enterica, gangguan integritas penghalang usus diamati 56). Para penulis berspekulasi bahwa mikrobiota usus mungkin telah terpengaruh oleh bakteriofag, tetapi data sekuensing tidak diberikan untuk mendukung klaim mereka.
Secara bersama-sama, perturbasi mikrobiota usus, yang mungkin merupakan konsekuensi dari intervensi yang beragam, dapat menyebabkan peningkatan permeabilitas usus dan translokasi komponen dan produk bakteri. Translokasi mikroba tersebut dapat memicu respons imun abnormal, menyebabkan peradangan dan / atau kerusakan jaringan pada organ ekstraintestinal.
Gejala Usus Bocor
Ada bukti kuat bahwa usus bocor dapat menyebabkan alergi makanan, penyakit radang usus (IBD) dan penyakit celiac. Ada bukti yang baik kebocoran usus dapat menyebabkan diabetes tipe 1 atau multiple sclerosis, dan penelitian yang lebih terbatas menghubungkannya dengan penyakit hati berlemak nonalkohol, steatohepatitis nonalkohol (NASH) dan diabetes tipe 2. Ahli-ahli lain percaya bahwa usus yang bocor berkontribusi pada berbagai macam penyakit yang lebih luas, seperti alergi musiman, depresi dan eksim.
Cara menyembuhkan usus bocor
Mempertimbangkan kontribusi dari usus bocor dan translokasi bakteri ke peradangan dan berbagai penyakit, membalikkan kebocoran usus tampaknya menjadi strategi terapi yang menarik. Prebiotik dan probiotik, misalnya, dapat digunakan untuk mengurangi permeabilitas usus 57). Beragam spesies probiotik telah ditemukan yang memiliki sifat untuk melindungi penghalang usus melalui penargetan komponen yang berbeda dari sistem penghalang mukosa. Human commensal Bacteroides fragilis dapat berfungsi sebagai probiotik seperti itu 58). Dalam model tikus, gangguan spektrum autisme (ASD) telah terbukti disertai oleh disfungsi penghalang usus, usus mikrobiota dysbiosis, dan kebocoran 4-ethylphenylsulfate (4EPS), yang berasal dari bakteri komensal. Ketika 4EPS diberikan kepada tikus tipe liar, itu secara langsung menyebabkan kelainan perilaku yang mirip dengan tikus ASD. Pengobatan dengan B. fragilis mengurangi translokasi 4EPS penyakit-kausatif, dan secara signifikan memperbaiki cacat perilaku. Manfaat terapi B. fragilis diyakini karena kemampuannya untuk mengubah komposisi mikroba dan meningkatkan fungsi penghalang usus 59). B. fragilis juga dikenal karena kemampuannya untuk menginduksi pengembangan Foxp3 + regulatory T cells, suatu proses yang diatur oleh produk lain dari B. fragilis, polisakarida A 60). B. fragilis dan polisakarida A bermanfaat terhadap penyakit inflamasi, seperti kolitis dan encephalomyelitis autoimun eksperimental 61). Penerapan B. fragilis untuk mencegah usus bocor dan reverse autoimmunity menjamin penyelidikan lebih lanjut.
Bakteri asam laktat dan Bifidobacteria diketahui mengeluarkan faktor yang meredam peradangan dengan menurunkan regulasi ekspresi gen tergantung NF-κB, sekresi IL-8, dan tingkat kemokin yang menarik makrofag 62). Bakteri asam laktat dan Bifidobacteria juga telah ditunjukkan untuk langsung menurunkan regulasi T-respon inflamasi mediator sementara meningkatkan regulasi ekspresi T regulator pada tikus 63). Mekanisme pasti bagaimana flora usus ini memodulasi respons imun masih belum dipahami dengan baik; dalam sudut pandang praktis, kandidat probiotik dengan target berbeda untuk membalikkan usus bocor mungkin secara sinergis bertindak untuk mengurangi penyakit karena dengan demikian dapat berfungsi sebagai koktail probiotik. Karena probiotik umumnya dianggap aman, maka diperkirakan bahwa mereka akan menjadi pilihan pengobatan yang efektif biaya untuk orang-orang dengan penyakit autoimun di masa mendatang. Ini adalah bidang yang sangat muda namun menarik di mana masih banyak yang harus dipelajari.
Referensi [ + ]